Research

基礎
心筋梗塞(虚血性心疾患)は、全世界において死因の上位を占める重篤な疾患です。近年、血行再建手術やカテーテル治療の発達によって、心筋梗塞患者の救命率は大幅に改善しました。一方で、救命はできたものの、心臓のポンプ機能が十分に回復せずに身体機能が低下し、日常生活に著しい制限を余儀なくされる患者さんも多くいらっしゃいます。このように心筋梗塞後の心不全に苦しむ患者さんが発生する要因として重要なものが、虚血再灌流障害です。虚血再灌流障害とは、虚血に陥った心筋の血流を再開させた際に、急激な再酸素化に伴って多量の活性酸素が生じ、これが細胞内の種々の蛋白を変性させてしてしまう現象です。心臓の虚血再灌流障害は、カテーテルや手術による虚血心筋の完全な救済にあたって大きな障壁となっているものの、いまだに確立した治療法はありません。
このラボでは、心臓の虚血再灌流障害のメカニズム解明に向けて、代謝に注目した研究を進めてきました。心臓の正確な代謝マップを作成する際に、心臓では、死後の低分子代謝産物の分解が急速であるため、急速冷却によるサンプル収集方法では重要な代謝産物が損失する問題がありました。そこで、代謝産物の分解酵素を瞬時に死活化させ、低分子代謝産物を安定化させる処理方法として、マイクロ波を用いたサンプルの処理を心臓に応用し、マウス心臓における高い空間解析度の代謝イメージング技術を開発することに成功しました。さらに、炭素13(13C)でラベルした基質を用いて、心筋梗塞モデルのグルコースおよび乳酸のトレースイメージングに成功し、虚血の中心部ではグルコースを乳酸に変換するとともに、乳酸を積極的にTCAサイクルで代謝していること、虚血の周辺部位ではグルコースを積極的にTCAサイクルで代謝していることが明らかとなりました(図1)。この成果は、2016年にscientific report誌に報告しています1。
また、動物(ラット)の心臓を用いて虚血再灌流を再現し、その過程で生じる代謝物質の変動を生きたままの状態で連続的かつ包括的に解析しました。従来の研究手法では、虚血再灌流後の心筋組織を採取し、種々の代謝物質や蛋白を測定することで治療の標的となる分子を探索していました。この方法では、時間とともにダイナミックに変化する心筋の代謝状態を追跡することは不可能でした。我々はこの問題を克服するために、筒状の半透膜を心臓の壁に埋め込み、この膜に透過して来る心筋間質の代謝物質を連続的に回収して測定する手法(マイクロダイアリシス法)を用いました。この方法を活用することで、従来の研究では達成し得なかった、虚血の前・虚血の最中・再灌流後の3つの時相のそれぞれについて、同一個体で連続的に心筋間質中の代謝物質を回収することに成功しました。その結果、心筋保護の鍵となる重要な因子であるグルタチオンという強力な還元物質が虚血および再灌流の時相で細胞外へ放出され、細胞内の活性酸素種を除去できなくなることを特定しました。さらにこの細胞外放出が、主にMRP1という特殊なトランスポーターを介していることを特定しました。
活性酸素の増大は細胞内のさまざまな分子にダメージを及ぼしますが、特に細胞膜のリン脂質が攻撃を受けやすいことが知られておりました。特に近年では、細胞膜の脂質が過剰に酸化されると、膜としての構造を保てなくなり細胞全体が死に至ってしまうことも知られて、この細胞死をフェロトーシスと言います。その仕組みは盛んに研究されているものの、酸化した脂質はバリエーションに富んでおり構造的にも不安定のため解析が難しく、どのような酸化脂質が、いつ発生するのか、その詳細についてはこれまでわかりませんでした。本共同研究チームは、独自の手法を用いて詳細な酸化脂質種の解析を実施しました。その結果、MRP1の機能を薬物で阻害すると細胞内にグルタチオンを保持することは、活性酸素の消去のみならず、酸化脂質の減少を達成し、心筋細胞の生存を助けることを発見しました。さらに、このようなフェロトーシスを標的にした治療法は、虚血再灌流後数時間後に開始しても一定の効果があることが示され、実際のヒトの治療法に応用可能なことがわかり、2023年にCirculation Research誌に報告しました2。
現在、心臓に加え、骨格筋にも注目して、代謝、酸化還元のイメージングに挑戦しています。
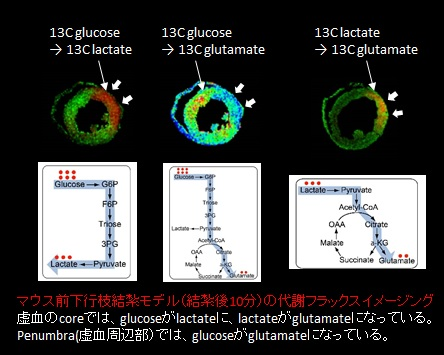
図1
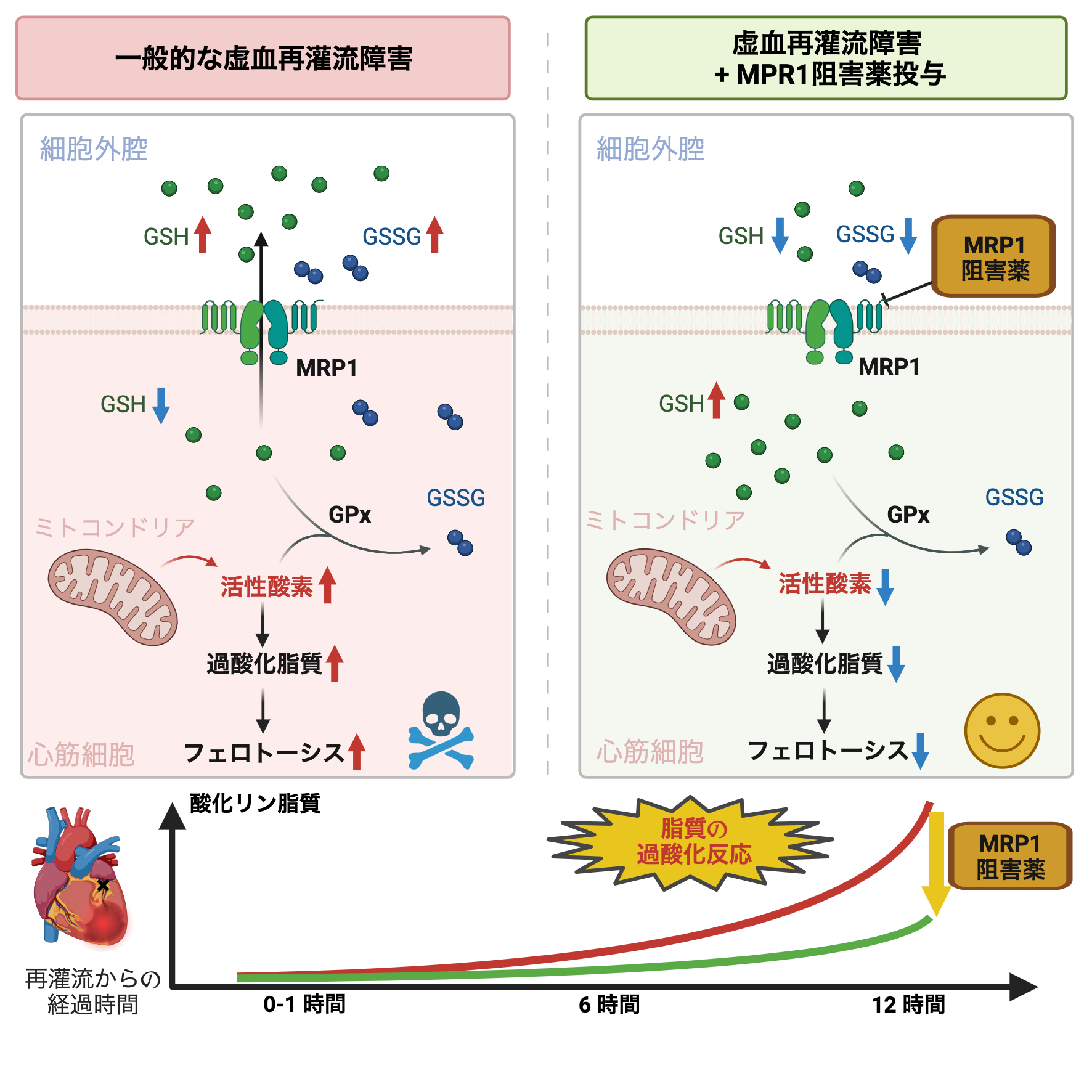
図2
関連する主要論文
1. Sugiura Y, Katsumata Y, et al. Visualization of in vivo metabolic flows reveals accelerated utilization of glucose and lactate in penumbra of ischemic heart. Sci Rep. 2016 Sep 1;6:32361. doi: 10.1038/srep32361.
2. Ichihara G, Katsumata Y, Sugiura Y, Matsuoka Y, Maeda R, Endo J, Anzai A, Shirakawa K, Moriyama H, Kitakata H, Hiraide T, Goto S, Ko S, Iwasawa Y, Sugai K, Daigo K, Goto S, Sato K, Yamada KI, Suematsu M, Ieda M, Sano M. MRP1-Dependent Extracellular Release of Glutathione Induces Cardiomyocyte Ferroptosis After Ischemia-Reperfusion. Circ Res. 2023 Oct 27;133(10):861-876. doi: 10.1161/CIRCRESAHA.123.323517.
3.Ko S, Anzai A, Liu X, Kinouchi K, Yamanoi K, Torimitsu T, Ichihara G, Kitakata H, Shirakawa K, Katsumata Y, Endo J, Hayashi K, Yoshida M, Nishimori K, Tanaka KF, Onaka T, Sano M, Ieda M. Social Bonds Retain Oxytocin-Mediated Brain- Liver Axis to Retard Atherosclerosis. Circ Res. 2025 Jan 3;136(1):78-90. doi: 10.1161/CIRCRESAHA.124.324638.
4.Sugai K, Hirano M, Oda A, Fujisawa M, Shono S, Ishioka K, Tamura T, Katsumata Y, Sano M, Kobayashi E, Hakamata Y. Establishment and application of a new 4/6 infarct nephrectomy rat model for moderate chronic kidney disease. Acta Cir Bras. 2024 Mar 11;39:e391324. doi: 10.1590/acb391324.
5.Yoshida Y, Uchida K, Kodo K, Ishizaki-Asami R, Maeda J, Katsumata Y, Yuasa S, Fukuda K, Kosaki K, Watanabe Y, Nakagawa O, Yamagishi H. A genetic and developmental biological approach for a family with complex congenital heart diseases-evidence of digenic inheritance. Front Cardiovasc Med. 2023 Apr 25;10:1135141. doi: 10.3389/fcvm.2023.1135141.
6.Hirano M, Katsumata Y, et al. Pharmacokinetics of hydrogen administered intraperitoneally as hydrogen-rich saline and its effect on ischemic neuronal cell death in the brain in gerbils. PLoS One. 2022 Dec 27;17(12):e0279410. doi: 10.1371/journal.pone.0279410.
7.Moriyama H, Katsumata Y, et al. Omega-3 fatty acid epoxides produced by PAF-AH2 in mast cells regulate pulmonary vascular remodeling. Nat Commun. 2022 May 31;13(1):3013. doi: 10.1038/s41467-022-30621-z.
8.Shirakawa K, Katsumata Y, st al. H2 Inhibits the Formation of Neutrophil
9.Extracellular Traps. JACC Basic Transl Sci. 2022 Jan 12;7(2):146-161. doi:10.1016/j.jacbts.2021.11.005.
10.Kitakata H, Katsumata Y, et al. Therapeutic Targets for DOX-Induced Cardiomyopathy: Role of Apoptosis vs. Ferroptosis. Int J Mol Sci. 2022 Jan 26;23(3):1414. doi: 10.3390/ijms23031414.
11.Ichihara G, Katsumata Y, et al. Pharmacokinetics of hydrogen after ingesting a hydrogen-rich solution: A study in pigs. Heliyon. 2021 Nov 11;7(11):e08359. doi: 10.1016/j.heliyon.2021.e08359.
12.Kitakata H, Katsumata Y, et al. MITOL/MARCH5 determines the susceptibility of cardiomyocytes to doxorubicin-induced ferroptosis by regulating GSH homeostasis. J Mol Cell Cardiol. 2021 Dec;161:116-129. doi: 10.1016/j.yjmcc.2021.08.006.
13.Kitakata H, Katsumata Y, et al. Imeglimin prevents heart failure with preserved ejection fraction by recovering the impaired unfolded protein response in mice subjected to cardiometabolic stress. Biochem Biophys Res Commun. 2021 Oct 1;572:185-190. doi: 10.1016/j.bbrc.2021.07.090.
14.Goto S, Ichihara G, Katsumata Y, et al. Time-Series Transcriptome Analysis Reveals the miR-27a-5p-Ppm1l Axis as a New Pathway Regulating Macrophage Alternative Polarization After Myocardial Infarction. Circ J. 2021 May 25;85(6):929-938. doi: 10.1253/circj.CJ-20-0783.
15.Sano M, Katsumata Y, et al. Low-Flow Nasal Cannula Hydrogen Therapy. J Clin Med Res. 2020 Oct;12(10):674-680. doi:10.14740/jocmr4323.
16.Tamura T, Katsumata et al. Hydrogen Gas Inhalation Attenuates Endothelial Glycocalyx Damage and Stabilizes Hemodynamics in a Rat Hemorrhagic Shock Model. Shock. 2020 Sep;54(3):377-385. doi:10.1097/SHK.0000000000001459.
17.Sano M, Katsumata Y, et al. Pharmacokinetics of a single inhalation of hydrogen gas in pigs. PLoS One. 2020 Jun 19;15(6):e0234626. doi: 10.1371/journal.pone.0234626.
18.Yamashita K, Katsumata Y, et al. Adrenal cortex hypoxia modulates aldosterone production in heart failure. Biochem Biophys Res Commun. 2020 Mar 26;524(1):184-189. doi: 10.1016/j.bbrc.2020.01.088.
19.Yamamoto T, Katsumata Y, et al. Sirt1 counteracts decrease in membrane phospholipid unsaturation and diastolic dysfunction during saturated fatty acid overload. J Mol Cell Cardiol. 2019 Aug;133:1-11. doi:10.1016/j.yjmcc.2019.05.019.
20.Matsuhashi T, Katsumata Y, et al. Pressure overload inhibits glucocorticoid receptor transcriptional activity in cardiomyocytes and promotes pathological cardiac hypertrophy. J Mol Cell Cardiol. 2019 May;130:122-130. doi: 10.1016/j.yjmcc.2019.03.019.
21.Isobe S, Katsumata Y et al. Endothelial-Mesenchymal Transition Drives Expression of CD44 Variant and xCT in Pulmonary Hypertension. Am J Respir Cell Mol Biol. 2019 Sep;61(3):367-379. doi: 10.1165/rcmb.2018-0231OC.
22.Shirakawa K, Katsumata Y, et al. Influence of long term administration of tofogliflozin on chronic inflammation of visceral adipose tissue in mice with obesity induced by a high-fat diet. PLoS One. 2019 Jan 25;14(1):e0211387. doi: 10.1371/journal.pone.0211387.
23.Yamamoto T, Katsumata Y, et al. Decrease in membrane phospholipids unsaturation correlates with myocardial diastolic dysfunction. PLoS One. 2018 Dec 11;13(12):e0208396. doi: 10.1371/journal.pone.0208396.
24.Shirakawa K, Katsumata Y,et al. IL (Interleukin)-10-STAT3-Galectin-3 Axis Is Essential for Osteopontin-Producing Reparative Macrophage Polarization After Myocardial Infarction. Circulation. 2018 Oct 30;138(18):2021-2035. doi: 10.1161/CIRCULATIONAHA.118.035047.
25.Sano M, Katsumata Y, et al. Promising novel therapy with hydrogen gas for emergency and critical care medicine. Acute Med Surg. 2017 Oct 24;5(2):113-118. doi:10.1002/ams2.320.
26.Shirakawa K, Katsumata Y, et al. Negative legacy of obesity. PLoS One. 2017 Oct 26;12(10):e0186303. doi: 10.1371/journal.pone.0186303.
27.Shirakawa K, Katsumata Y, et al. Obesity accelerates T cell senescence in murine visceral adipose tissue. J Clin Invest. 2016 Dec 1;126(12):4626-4639. doi: 10.1172/JCI88606.
28.Yamamoto T, Katsumata Y, et al. . Cardiac Sirt1 mediates the cardioprotective effect of caloric restriction by suppressing local complement system activation after ischemia-reperfusion. Am J Physiol Heart Circ Physiol. 2016 Apr 15;310(8):H1003-14. doi: 10.1152/ajpheart.00676.2015.
29.Matsuhashi T, Katsumata Y, et al. Activation of pyruvate dehydrogenase by dichloroacetate has the potential to induce epigenetic remodeling in the heart. J Mol Cell Cardiol. 2015 May;82:116-24. doi: 10.1016/j.yjmcc.2015.02.021.
30.Shinmura K, Katsumata Y, et al. Indispensable role of endothelial nitric oxide synthase in caloric restriction-induced cardioprotection against ischemia-reperfusion injury. Am J Physiol Heart Circ Physiol. 2015 Apr 15;308(8):H894-903. doi:10.1152/ajpheart.00333.2014.
31.Anzai A, Katsumata Y, et al. Adventitial CXCL1/G-CSF expression in response to acute aortic dissection triggers local neutrophil recruitment and activation leading to aortic rupture. Circ Res. 2015 Feb 13;116(4):612-23. doi: 10.1161/CIRCRESAHA.116.304918.
32.Yan X, Katsumata Y, et al. Lung natural killer cells play a major counter-regulatory role in pulmonary vascular hyperpermeability after myocardial infarction. Circ Res. 2014 Feb 14;114(4):637-49. doi: 10.1161/CIRCRESAHA.114.302625.
33.Katsumata Y, Sano M, et al. Endogenous prostaglandin D2 and its metabolites protect the heart against ischemia-reperfusion injury by activating Nrf2. Hypertension. 2014 Jan;63(1):80-7. doi:10.1161/HYPERTENSIONAHA.113.01639.
34.Yan X, Katsumata Y, et al. Temporal dynamics of cardiac immune cell accumulation following acute myocardial infarction. J Mol Cell Cardiol. 2013 Sep;62:24-35. doi: 10.1016/j.yjmcc.2013.04.023.
35.Yan X, Katsumata Y, et al. Deleterious effect of the IL-23/IL-17A axis and γδT cells on left ventricular remodeling after myocardial infarction. J Am Heart Assoc. 2012 Oct;1(5):e004408. doi: 10.1161/JAHA.112.004408.
36.Ito H, Katsumata Y, et al. PGD2-CRTH2 pathway promotes tubulointerstitial fibrosis. J Am Soc Nephrol. 2012 Nov;23(11):1797-809. doi: 10.1681/ASN.2012020126.
37.Inagawa K, Katsumata Y, et al. Induction of cardiomyocyte-like cells in infarct hearts by gene transfer of Gata4, Mef2c, and Tbx5. Circ Res. 2012 Oct 12;111(9):1147-56. doi:10.1161/CIRCRESAHA.112.271148.
38.Morizane S, Katsumata Y, et al. Biphasic time course of the changes in aldosterone biosynthesis under high-salt conditions in Dahl salt-sensitive rats. Arterioscler Thromb Vasc Biol. 2012 May;32(5):1194-203. doi: 10.1161/ATVBAHA.111.242719.
39.Shinmura K, Katsumata Y, et al. Caloric restriction primes mitochondria for ischemic stress by deacetylating specific mitochondrial proteins of the electron transport chain. Circ Res. 2011 Aug 5;109(4):396-406. doi: 10.1161/CIRCRESAHA.111.243097.
40.Zhang Y, Katsumata Y, et al. 4-hydroxy-2-nonenal protects against cardiac ischemia-reperfusion injury via the Nrf2-dependent pathway. J Mol Cell Cardiol. 2010 Oct;49(4):576-86. doi:10.1016/j.yjmcc.2010.05.011.
41.Endo J, Katsumata Y, et al. Metabolic remodeling induced by mitochondrial aldehyde stress stimulates tolerance to oxidative stress in the heart. Circ Res. 2009 Nov 20;105(11):1118-27. doi:10.1161/CIRCRESAHA.109.206607.
研究費
1.平成23年度 慶應義塾大学博士課程学生研究支援プログラム、助成テーマ「ストレス応答シグナルであるeIF2aの心筋での作用および創薬標的分子の開発」
2.平成23年 度 慶應義塾大学医 学 部 研 究 奨 励 費、助成テーマ「ストレス応答シグナルであるeIF2 a の心筋での作用および創薬標的分子の開発
3.平成23年度 慶應医師会医学研究助成金、助成テーマ「ストレス応答シグナルであるeIF2 aの心筋での作用および創薬標的分子の開発」
4.平成24年度 慶應義塾大学博士課程学生研究支援プログラム、助成テーマ「メタボロームイメージングを用いた虚血再灌流時の低分子代謝産物の解析」
5.平成24年度 坂口光洋記念慶應義塾医学振興基金医学国際交流事業助成金、助成テーマ「Prostaglandin D2-F type prostanoid receptor signaling is a novel cardiomyocyte survival pathway」
6.平成23年 度 慶應義塾大学医 学 部 研 究 奨 励 費、助成テーマ「心臓におけるメタボロームイメージングの確立および移植心筋の代謝マップ作製」
7.平成26年度 科学研究費助成事業(日本学術振興会学術研究助成基金助成金)、助成テーマ「心臓におけるメタボロームイメージングの確立および移植心筋の代謝マップ作製」
8.2018年度 日本循環器学会基礎研究助成、「心臓におけるin vivo 四次元代謝イメージング技術の開発と応用」
9.2019年度 日本新薬株式会社公募研究助成、”Hot-Spot”に着目した肺高血圧症の新規疾患モデル構築と発症病態機構の解明
10.平成31年 科学研究費助成事業(日本学術振興会日本学術振興会)、助成テーマ「心臓におけるin vivo 四次元代謝イメージング技術の開発と応用」
11.2019年度 日本医療研究開発機構(AMED)橋渡し研究戦略的推進プログラム、助成テーマ「心筋症に対する、QSI法を用いた新たな心臓MRI解析技術の開発」
12.2020年度 山内進循環器病研究助成(公益財団法人 循環器病研究振興財団)、助成テーマ「心筋症に対する、QSI法を用いた新たな心臓MRI解析技術の開発」
13.2021年度 科学研究費補助金(日本学術振興会日本学術振興会)・基盤研究C、助成テーマ「心臓における、警告シグナルとしてのグルタチオンの新たな機能の解明」
14.2021年度 先進医薬研究振興財団 循環医学分野 一般研究助成、助成テーマ「心臓における、警告シグナルとしてのグルタチオンの新たな機能の解明」
15.第35回中冨健康科学振興財団研究助成金、助成金150万、「低酸素運動を活用したがん増殖抑制メカニズムの解明」出資先:公益財団法人中冨健康科学振興財団
本研究に従事している関係者
慶應義塾大学スポーツ医学総合センター
勝俣良紀、菅井和久、岩澤佑治、市原元気